Oggi facciamo quattro chiacchiere sul vino. Al link qui sotto l’intervista con VinOsa
Il vino nella scienza e la scienza del vino. Quattro chiacchiere con il chimico.
C’è anche il link alla pagina Facebook:
Oggi facciamo quattro chiacchiere sul vino. Al link qui sotto l’intervista con VinOsa
Il vino nella scienza e la scienza del vino. Quattro chiacchiere con il chimico.
C’è anche il link alla pagina Facebook:
Guardate la foto di Figura 1. Il bicchiere sembra vuoto. In realtà avevo appena finito di bere un buonissimo vino e in controluce si osservano quelle che gli esperti chiamano le “lacrime del vino“. Di cosa si tratta?

Il titolo di questa nota richiama il nome di un fisico italiano, il Dr. Marangoni, che nel 1865 per primo razionalizzò la formazione di queste lacrime. A onor del vero, il Dr. Marangoni studiò la dinamica del trasferimento di massa lungo una superficie. All’interno del modello da lui sviluppato si inquadra la formazione delle suddette lacrime.
Prendiamo in considerazione una miscela di due liquidi che, per semplicità, indichiamo con A e B. Dalla chimica sappiamo che ogni liquido è in equilibrio con il suo vapore attraverso la relazione:
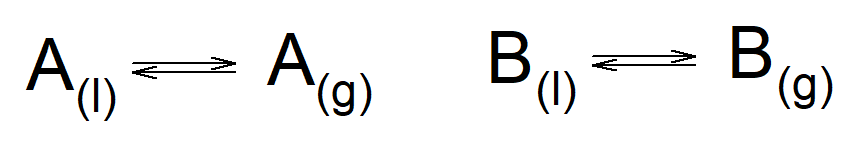
Nell’immagine ho considerato le due componenti della miscela separatamente. I pedici (l) e (g) indicano la fase liquida e gassosa, rispettivamente.
Gli equilibri descritti sono tanto più spostati verso la fase gassosa quanto più piccolo è lo spessore della fase liquida. Una spiegazione semplicistica di ciò è che più piccolo è lo spessore, minore è la forza con cui le molecole sono tenute legate alla superficie del liquido. Come conseguenza, le molecole sulla superficie di uno strato di liquido sottile riescono a “passare” più facilmente alla fase gassosa rispetto a quelle che sono sulla superficie di uno strato di liquido più spesso.
Quando i due liquidi vengono mescolati, l’equilibrio tra le fasi si può descrivere così:
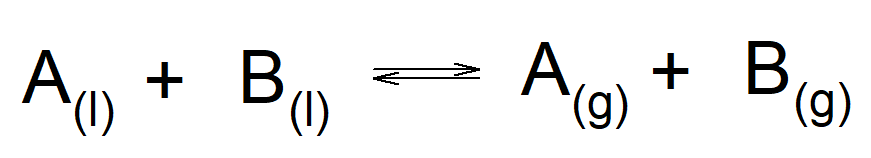
In altre parole, ciò che è presente nella fase liquida lo è anche in quella gassosa. Ciò che cambia nella composizione della fase liquida rispetto a quella gassosa è il rapporto relativo tra le componenti.
Supponiamo, tanto per esempio, che la componente A abbia un punto di ebollizione più elevato rispetto a quello della componente B. Questo vuol dire che a parità di temperatura, le molecole di B si allontanano dalla superficie liquida più facilmente delle molecole di A. La conseguenza è che mentre la fase liquida contiene una maggiore quantità del composto A (che è più alto bollente), la fase gassosa contiene una maggiore quantità del composto B (che è più basso bollente).
La miscela fatta da A e B ha proprietà fisiche che sono intermedie tra quelle delle singole componenti. Ma cosa accade quando la stessa miscela si trova in due situazioni fisiche differenti, ovvero in un caso la fase liquida ha uno spessore più grande che nell’altro?
Quando diminuiamo lo spessore della fase liquida, la fase gassosa si arricchisce della componente più basso bollente e la densità del liquido (cioè il peso per unità di volume) tende verso quella della componente più alto bollente. Volendo semplificare con un linguaggio pseudo matematico, possiamo scrivere:
d(A+B) →dA
dove la lettera d indica la densità; il pedice (A+B) si riferisce alla miscela, mentre la freccia (→) si legge “tende”.
Avete presente l’acqua? Sì…proprio quella che si scrive H2O. Ebbene, quando questa molecola è assieme alle sue sorelle gemelle, accade che si generino delle proprietà che ogni singola molecola presa da sola non ha. In effetti quando diciamo che l’acqua bolle a 100 °C o diventa solida a 0 °C non stiamo parlando di proprietà di una singola molecola. Temperatura di ebollizione, temperatura di fusione, densità etc. sono tutte proprietà che fanno riferimento ad insiemi di molecole che interagiscono tra loro. Le molecole di acqua, in particolare, interagiscono tra loro mediante una rete di legami a idrogeno. Per semplicità rimando ad una mia nota per comprendere il ruolo che i legami a idrogeno hanno nel determinare alcune caratteristiche dell’acqua.
Qui sotto, invece, un altro articolo in cui si evidenzia come i legami a idrogeno influenzino la dinamica dei protoni e degli ossidrilioni.
I legami a idrogeno sono anche responsabili di quella che viene indicata come tensione superficiale dell’acqua.
Prendiamo una bacinella e riempiamola di acqua. Immaginiamo ora di diventare piccoli fino ad arrivare alle dimensioni delle molecole di acqua. Quello che potremmo immaginarci di vedere all’interno della bacinella è un insieme di molecole che interagiscono tra loro in modo differente a seconda della loro posizione nel contenitore (Figura 2).
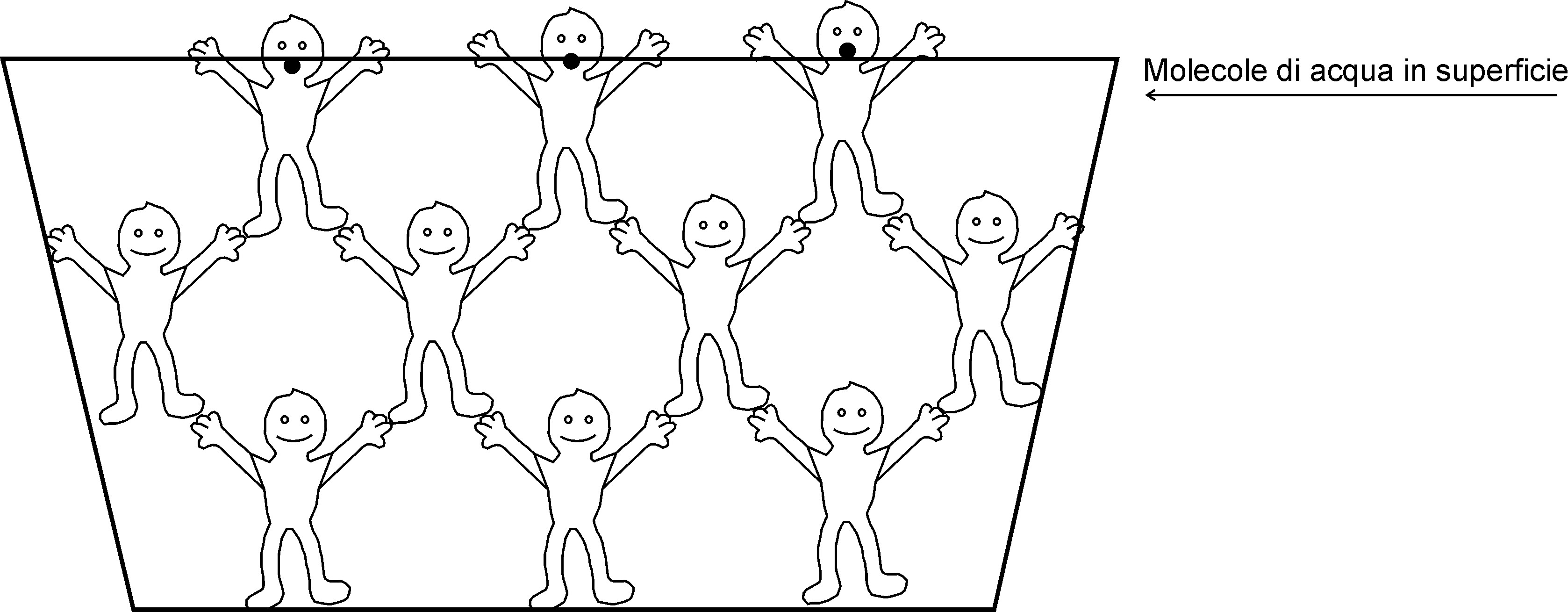
In particolare, le molecole di acqua che sono nel bel mezzo della bacinella sono circondate da analoghe molecole che le attraggono con forze (dovute ai legami a idrogeno intermolecolari) identiche in tutte le direzioni.
Le molecole di acqua che sono accanto alle pareti del recipiente sono attratte con forze di un certo tipo dalle pareti e con forze differenti dalle molecole di acqua ad esse vicine. Cerchiamo di capire perché. Ho già scritto che le forze che consentono alle molecole di acqua di interagire tra loro sono dovute ai legami a idrogeno intermolecolari. Per completezza aggiungo che queste forze vengono indicate come “forze di coesione” perché consentono alle molecole di acqua di essere “coese” tra loro. Le forze con le quali le pareti del recipiente agiscono sulle molecole di acqua con cui entrano in contatto si indicano come “forze di adesione”. Esse possono essere dovute sia alla formazione di dipoli indotti che a legami a idrogeno veri e propri. Questi ultimi, tuttavia, hanno energia differente rispetto a quelli che si formano tra identiche molecole di acqua a causa della differente natura chimica delle pareti del contentinore.
Infine, le molecole di acqua che si trovano in superficie risentono, da un lato, della presenza dei legami a idrogeno con analoghe molecole più interne nel liquido, dall’altro della presenza dell’aria atmosferica con cui esse non possono interagire allo stesso modo. Per questo motivo, l’energia termica necessaria per far “staccare” le molecole dalla superficie è meno intensa di quella necessaria per far allontanare le molecole più interne che sono “ancorate” meglio ad un numero maggiore di molecole di acqua.
Adesso restringiamo la bacinella di prima alle dimensioni di un capillare e cerchiamo di capire cosa accade (Figura 3).
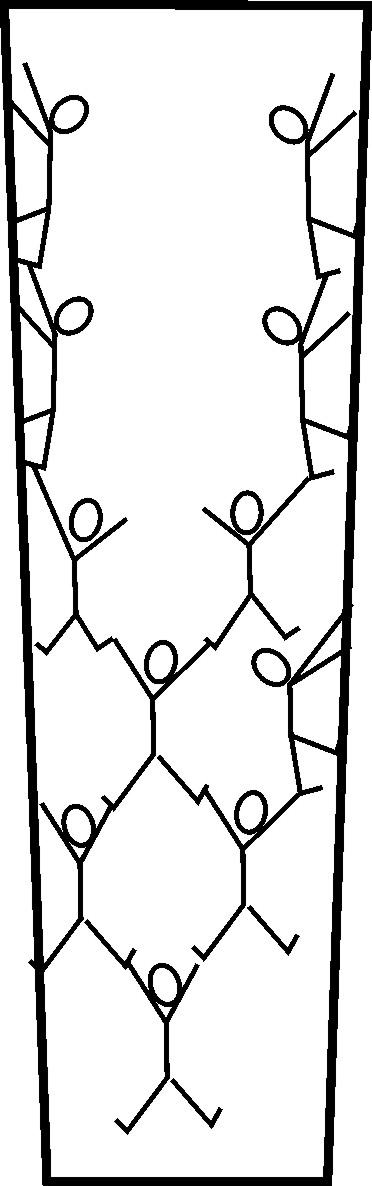
In pratica diminuisce lo spazio a disposizione delle molecole di acqua che cominciano ad interagire sempre più fortemente con le pareti del recipiente. Le molecole a contatto con le pareti iniziano, quindi, ad “arrampicarsi” e si “trascinano” dietro tutte quelle che non sono direttamente interagenti con le pareti stesse. A causa delle forze di coesione più intense nella zona di spazio centrale (quella più lontana dalle pareti, per intenderci) si genera un menisco. Da un punto di vista fisico si osserva un fenomeno che senza le spiegazioni appena date aparirebbe magico, ovvero quella che è conosciuta comunemente come risalita capillare. Essa spiega la presenza di elevate concentrazioni di sali sulla superficie di suoli indicati come suoli salini, il movimento della linfa nelle piante e l’imbibizione di materiali porosi come la carta Scottex® che usiamo in cucina per asciugare le superfici su cui abbiamo fatto cadere l’acqua.
Siamo arrivati al momento cruciale: la spiegazione chimico-fisica delle lacrime del vino.
Il vino è una miscela complessa in cui le due componenti più importanti sono acqua e alcol etilico (indicato volgarmente con il solo termine di “alcol”). Non me ne vogliano gli enologi, ma il vino altro non è che una soluzione acquosa di alcol etilico. La poesia che i sommelier e gli enologi vedono nel vino è dovuta ad una piccolissima quantità di altre componenti che sono responsabili del sapore e del profumo di tale bevanda.
Tra le due componenti più abbondanti del vino, l’acqua è la più alto bollente (la temperatura di ebollizione a 1 atm è 100 °C), mentre l’etanolo ha una temperatura di ebollizione più bassa (a 1 atm, l’etanolo bolle a circa 78 °C). Aggiungiamo anche che la densità dell’etanolo a temperatura ambiente è circa 0.78 g/cm3 e quella dell’acqua è circa 1.0 g/cm3. La densità media dei vini è circa 0.99 g/cm3.
Mettiamo ora idealmente del vino in un calice e ruotiamo il calice (Figura 4).

Per effetto della rotazione, si genera un sottilissimo strato di liquido sulle pareti del calice. Alla luce di tutto quanto descritto nei paragrafi precedenti, ne viene che l’alcol etilico si allonatana facilmente da questo strato sottile. A causa di ciò, si intensificano le forze di adesione che spingono il liquido verso l’alto. Più il liquido si sposta verso l’alto, più si assottiglia lo strato e più facilmente l’alcol evapora. Come conseguenza aumenta progressivamente anche la densità del liquido nello strato sottile, ovvero aumenta il peso per unità di volume. Questo perché, alla luce delle spiegazioni date prima, la densità del liquido tende a quella dell’acqua. Quando, per effetto dell’aumento di densità, la forza di gravità diventa predominante sulle forze di adesione, l’anello di liquido che sale verso l’alto si rompe ed incominciano a formarsi gocce ed archetti, ovvero le lacrime del vino. Qualitativamente parlando, più elevato è il contenuto alcolico del vino e più elevato è il numero di gocce ed archetti.
No. Non sempre le lacrime si formano. Come abbiamo visto, è necessario che per effetto della rotazione e conseguente evaporazione dell’alcol etilico, si intensifichino le forze di adesione che spingono lo strato sottile di liquido verso l’alto. Come ho già scritto, le forze di adesione sono dovute a interazioni dipolari e/o legami a idrogeno. Questo significa che se non ci sono “agganci” a cui le molecole di acqua si possono ancorare, non si possono formare le lacrime del vino. In altre parole, le lacrime dipendono da quanto bene abbiamo lavato i nostri calici. Se il lavaggio ha completamente “sgrassato“ le pareti del recipiente, gocce ed archetti non si formano.
Se avete voglia di leggere curiosità in merito a viti, vitigni, vinificazione e vini potete andare a leggere il blog di VinOsa