Chiedo scusa ai miei lettori, ma questa pillola di scienza oggi è dedicata ai miei studenti ed a tutti quelli che hanno studiato la chimica organica. Per questo motivo userò un linguaggio poco divulgativo ed abbastanza tecnico.
Il linguaggio comune ed il linguaggio scientifico: usi ed abusi
Il termine “aromatico” viene attribuito, nel linguaggio comune, a un oggetto che emana un buon odore. Si tratta quindi di una qualità che viene associata a qualcosa di “buono”. Quante volte abbiamo sentito, o noi stessi abbiamo detto, “senti che buon aroma di caffè” oppure “hmmmm che buon profumo ha questa zuppa” laddove il termine “profumo” è sinonimo di “aroma”.
Ebbene, noi chimici, a causa delle limitazioni del nostro linguaggio, siamo abituati a prendere i termini comuni ed a cambiar loro di significato per attribuirne uno di carattere molto più tecnico. Ecco perché mi salta subito la mosca al naso quando sento le persone parlare di chimica o, più in generale, di scienza usando termini tecnici di cui, però, non conoscono il significato. Queste persone pensano che usare parole prese dal linguaggio scientifico e messe in fila in modo casuale dia un’àura di scientificità alle cose che dicono. Solo per citare pochi esempi mi vengono in mente quelli che esaltano la biodinamica scrivendo “robe” come quelle che vedete nell’immagine qui sotto. Cliccando sull’immagine si apre la pagina dalla quale ho fatto lo screenshot.
Che dire poi di quelli che si sono votati all’omeopatia, pratica esoterica di cui parlo abbondantemente in uno dei capitoli del mio libro “Frammenti di Chimica“? Ne ho già parlato tante volte. Alcune delle chicche sono analizzate nel link qui sotto:
Cosa significa aromatico in chimica
Lasciamo da parte le polemiche e concentriamoci sul significato dell’aggettivo “aromatico” nel linguaggio chimico. Se cerchiamo sulla Treccani online, possiamo leggere:
aromàtico agg. [dal lat. tardo aromatĭcus, gr. ἀρωματικός] (pl. m. –ci). – […] In chimica organica, composti a. (così denominati perché vi appartengono molte sostanze aromatiche), serie di composti ciclici nella cui molecola sono contenuti uno o più sistemi a sei atomi di carbonio disposti ad anello (distinti in omociclici e eterociclici a seconda che ai vertici dell’anello si trovino tutti atomi di carbonio o anche altri atomi)
Questo è il classico esempio di informazione così generale da perdere completamente di significato in termini chimici. Infatti esistono tanti composti omociclici ed eterociclici che non hanno assolutamente la caratteristica di essere aromatici. E non necessariamente devono essere presenti sistemi ciclici a sei atomi di carbonio.
La regola di Hückel
Da un punto di vista chimico un sistema organico si dice aromatico quando:
- contiene 4n+2 elettroni π (con n intero e ≥ 0)
- è ciclico e planare
In tutti gli altri casi il sistema si dice antiaromatico. I sistemi aromatici hanno come peculiarità la bassa reattività, ovvero elevata stabilità chimica.
Vediamo alcuni esempi di composti aromatici ed antiaromatici
Il benzene è un sistema ciclico con la struttura descritta nella figura seguente:
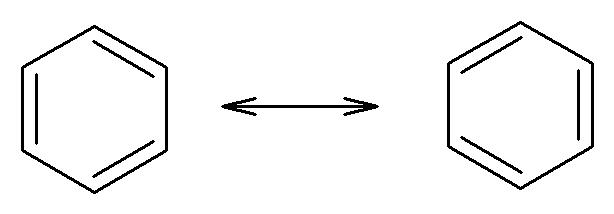
La posizione dei doppi legami cambia e le due strutture, del tutto equivalenti, sono indicate come ibridi di risonanza. Nel sistema π del benzene sono presenti 6 elettroni, ovvero rispetta la regola del 4n+2 per n=1. Qui sotto viene evidenziato come l’ibridazione (sp2) degli atomi di carbonio consenta alla molecola di avere una struttura planare.
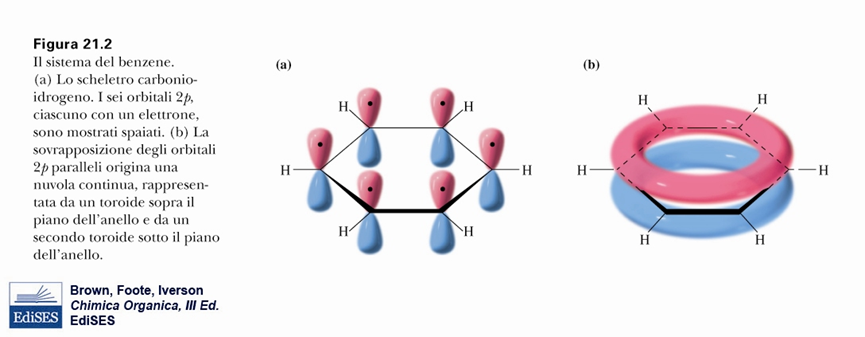
Entrambe le condizioni della regola di Hückel sono rispettate ed il benzene può essere considerato un composto aromatico.
Prendiamo adesso in considerazione il [10]annulene qui sotto:
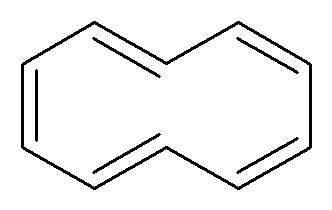
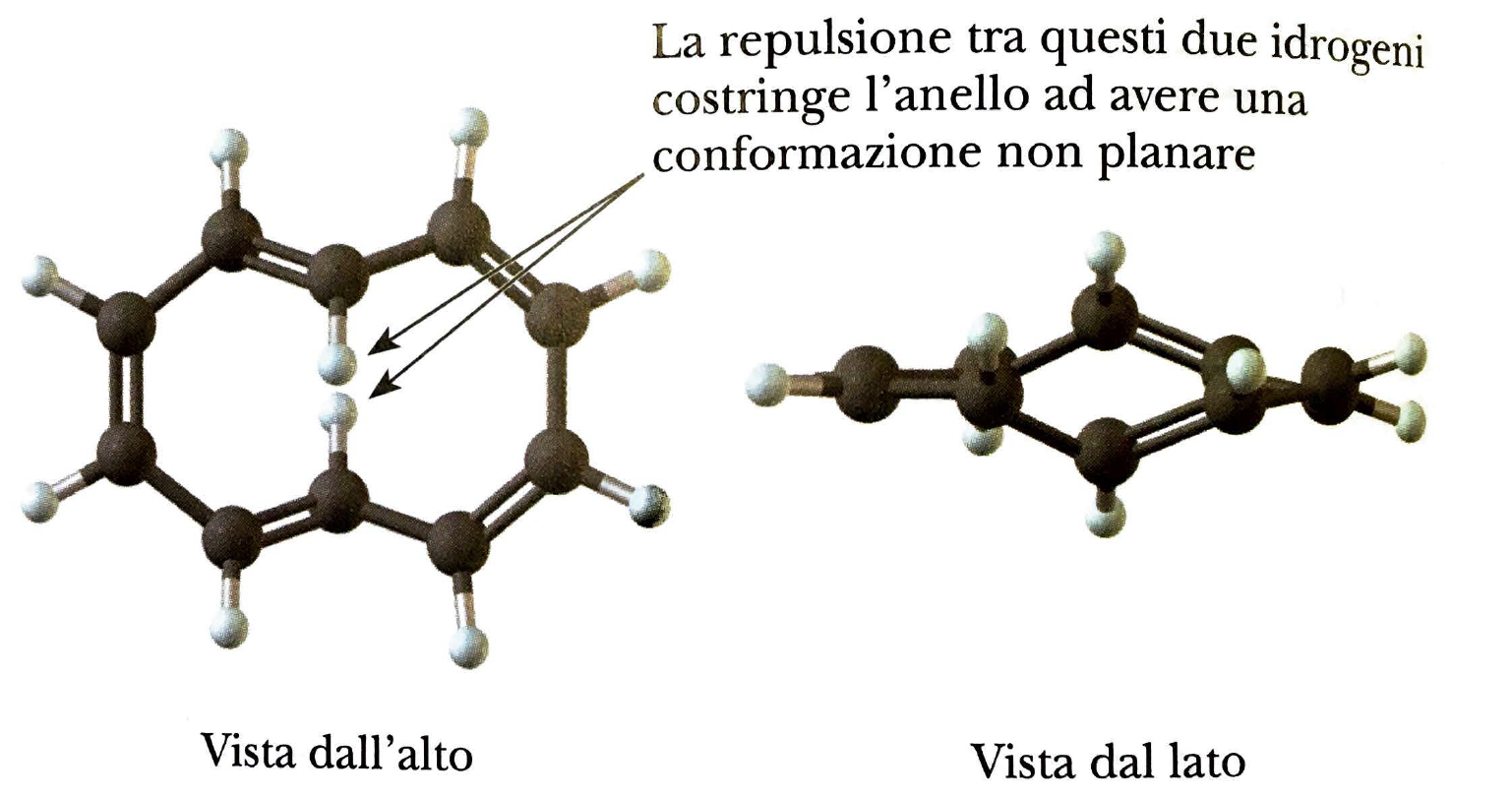
C’è un anello, ci sono 10 elettroni π. Il numero di elettroni nel sistema π segue la regola di Hückel del 4n+2 per n=2. Tuttavia il composto non è aromatico perché non ha una struttura planare:
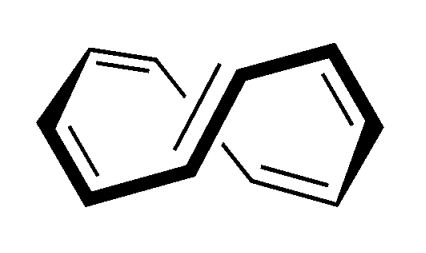
La non planarità è dovuta al fatto che gli atomi di idrogeno indicati nella figura sottostante si respingono per effetto sterico portando la molecola ad avere una struttura a twist.
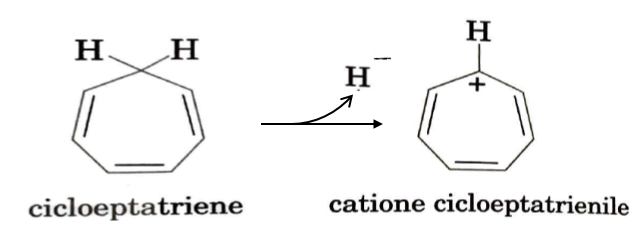
Lo ione tropilio
Quando si studia la chimica organica e si arriva al capitolo sull’aromaticità, ci si imbatte anche nello ione tropilio (o catione cicloeptatrienile) che viene, in genere, indicato come lo ione più grande avente caratteristiche aromatiche. Esso si ottiene per allontanamento dello ione idruro dal cicloeptatriene. Quest’ultimo, pur avendo 6 elettroni π (n=1 nella regola di Hückel), non è aromatico a causa di un carbonio sp3 che lo rende non planare. Quando lo ione idruro viene allontanato, tutti gli atomi di carbonio risultano di tipo sp2, il sistema diventa planare, il numero di elettroni è quello previsto dalla regola di Hückel e lo ione è aromatico.
I sistemi aromatici “giganti”
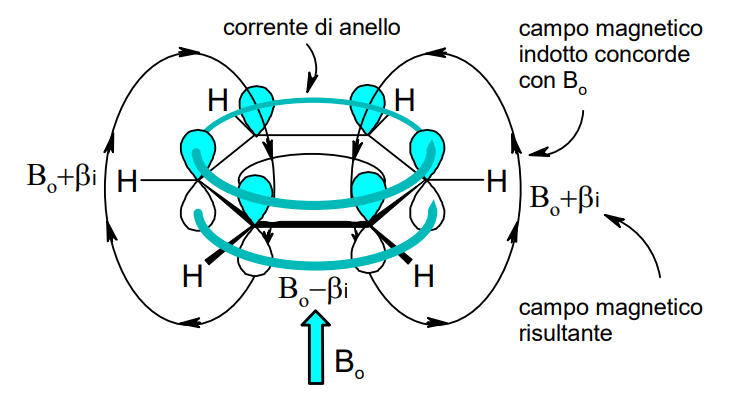
La regola di Hückel è un utile strumento per comprendere cosa significhi il termine “aromatico” in chimica . Questa regola è di applicabilità generale e può essere validata sperimentalmente attraverso l’uso della spettroscopia di risonanza magnetica nucleare (NMR). Infatti, gli elettroni del sistema π di un composto aromatico generano una corrente di anello (ring current) responsabile di un campo magnetico locale che si addiziona o si sottrae al campo magnetico applicato durante l’esperimento NMR. La variazione del campo magnetico dovuta alla corrente di anello comporta uno shift dei segnali dei nuclei soggetti a tale fenomeno. Per un approfondimento di carattere didattico cliccare qui.
La spettroscopia di risonanza magnetica nucleare è la tecnica usata per sfatare un mito in base al quale più grande è la molecola contenente 4n+2 elettroni π e più facilmente essa è in grado di deformarsi così da allontanarsi dalle condizioni strutturali che soddisfano la regola di Hückel.
Nel 2016 è stato pubblicato un lavoro (qui) in cui viene descritta una molecola aromatica contenente fino a 62 elettroni π (ovvero n=15 nella regola del 4n+2):
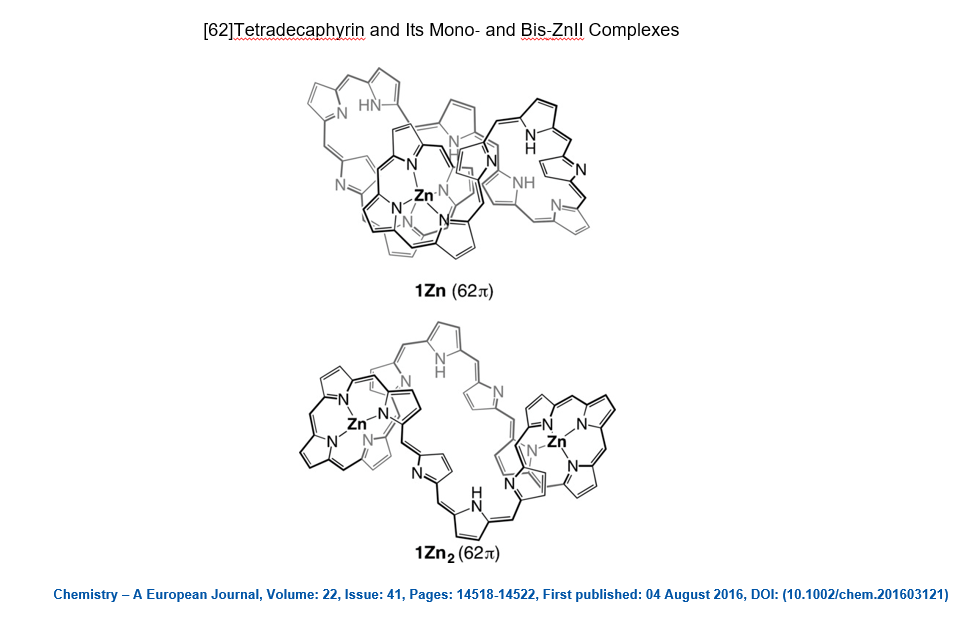
Come mai una molecola così grande, la più grande sintetizzata fino al 2016, si comporta come un sistema aromatico rispettando la regola di Hückel? Gli autori dell’articolo ipotizzano che l’enorme flessibilità della molecola consenta la coesistenza di tanti conformeri. Tra questi possono sussistere dei conformeri in cui le nuvole elettroniche di tipo π interagiscano tra loro in modo da portare ad una delocalizzazione elettronica in grado di soddisfare la regola di Hückel. Questa stessa spiegazione è stata usata per giustificare il comportamento aromatico di una molecola sintetizzata più recentemente (il lavoro è stato pubblicato il 20 Gennaio 2020, qui) contenente ben 162 elettroni π (ovvero n=40 nella regola del 4n+2). Si tratta di una vera e propria ruota gigantesca in cui coesistono 12 anelli porfirinici.
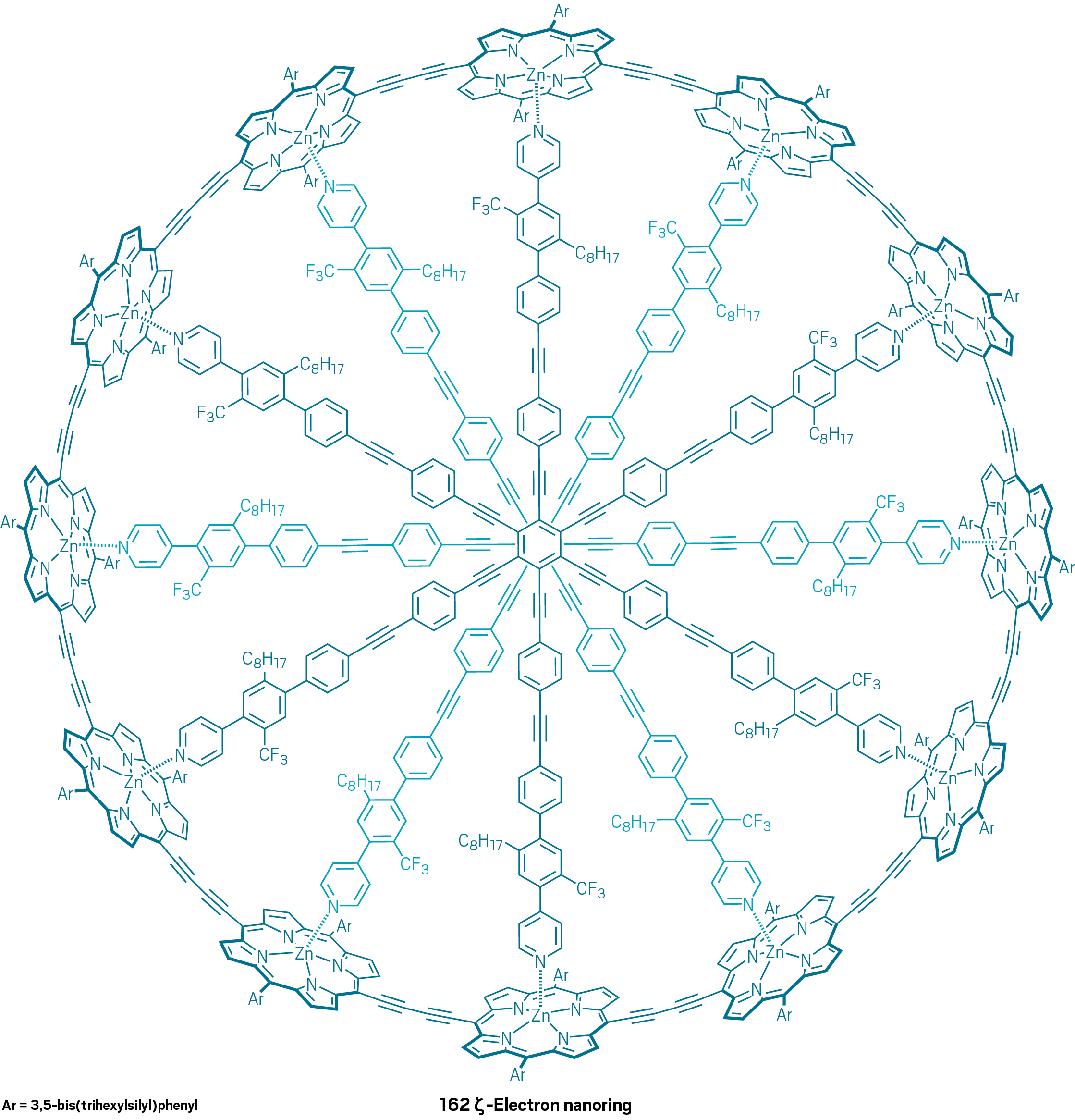
Conclusioni
A questo punto mi potreste chiedere: ok. Bella tutta ‘sta storia, ma a che serve? Voglio evidenziare che la sintesi di molecole così grandi consente di mettere a punto protocolli che possono essere usati per la sintesi di molecole diverse e con attività biochimiche da sfruttare per l’elaborazione di nuovi farmaci. Per poter “vedere” queste molecole è necessario spingersi ai limiti delle tecniche analitiche più utilizzate in chimica. Questo vuol dire che vengono migliorate le caratteristiche di tecniche che possono diventare di applicazione sempre più ampia e consentire di arrivare a limiti finora inesplorati. Infine, queste molecole aromatiche giganti possono essere utilizzate per studiare gli effetti quantistici a livello nanoscopico ben oltre i limiti imposti dalle dimensioni della costante di Planck.
Quando leggo queste notizie, che per me sono affascinanti perché mi consentono di immergermi in un mondo tutto mio, mi ricordo perché mi sono innamorato della chimica ed ho fatto del mio hobby il mio lavoro.
Letture consigliate
Even Huge Molecules Follow the Quantum World’s Bizarre Rules
Quantum superposition of molecules beyond 25 kDa
Porphyrin wheel sets record as largest aromatic ring
[62]Tetradecaphyrin and Its Mono- and Bis-ZnII Complexes