Avete presente la classica robetta sul mettere il sale prima o dopo che l’acqua ha cominciato a bollire? Questa cosa mi ha sempre lasciato perplesso perché ho sempre pensato che chiunque abbia frequentato con profitto le scuole superiori conosca le proprietà colligative e sa cosa significa innalzamento ebullioscopico. Traduco per i meno esperti: l’innalzamento ebullioscopico è l’innalzamento della temperatura di ebollizione di un solvente quando in esso vengano aggiunti dei soluti. Nel caso specifico, il solvente è l’acqua mentre il soluto è il cloruro di sodio (NaCl), popolarmente conosciuto come sale da cucina.
La solubilità in acqua del cloruro di sodio a 100 °C è di circa 400 g L-1.
L’innalzamento ebullioscopico si calcola usando la formuletta:
ΔT=keb · m · i (1)
dove ΔT è la variazione della temperatura di ebollizione tra il solvente che contiene il soluto e quella del solvente puro; keb è una costante che si chiama costante ebullioscopica. Essa è tabulata per ogni solvente. Per l’acqua, la keb assume il valore di 0.512 °C kg mol-1. Infine, m è la cosiddetta molalità, ovvero la concentrazione di soluto espressa in mol kg-1, dove il peso si riferisce al solvente usato, mentre i è il cosiddetto coefficiente di Vant’Hoff.
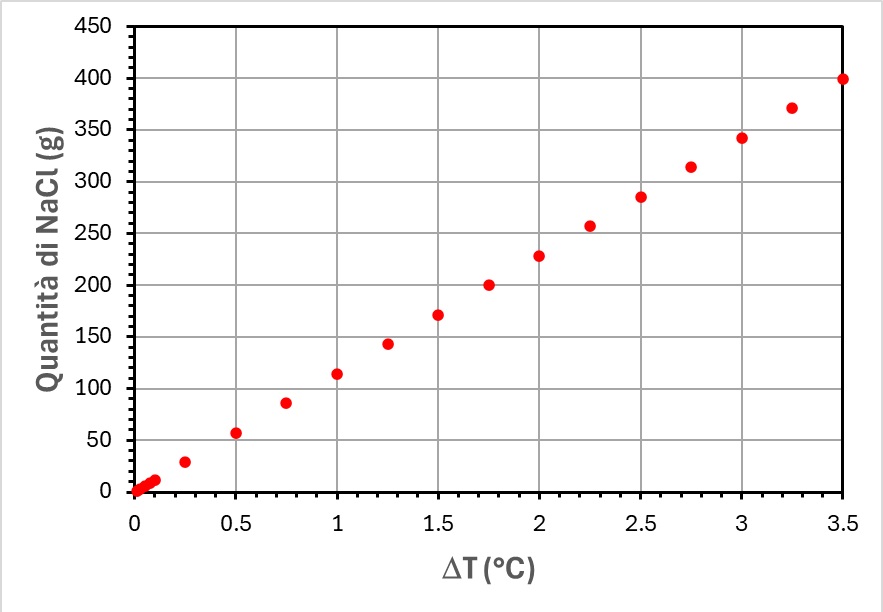
Adesso possiamo applicare la formuletta (1) per calcolare quale quantità di cloruro di sodio permette di alzare la temperatura di ebollizione dell’acqua di quantità note. Quelle che che ho preso in considerazione sono le seguenti:
ΔT = 0.01; 0.025; 0.05; 0.075; 0.1; 0.25; 0.5; 0.75; 1; 1.25; 1.5; 1.75; 2; 2.25; 2.5; 2.75; 3; 3.25; 3.5
Dal grafico riportato nella figura qui sotto, ne viene che per aumentare di un solo grado centigrado la temperatura di ebollizione di un litro di acqua occorrono circa 114 g di NaCl. In realtà, noi non aggiungiamo mai oltre 100 g di sale nell’acqua che mettiamo a bollire per la pasta. Tutt’al più ne usiamo un decimo, ovvero circa una decina di grammi. Dallo stesso grafico si evince come l’aggiunta di una decina di grammi di NaCl ad un litro di acqua innalza il punto di ebollizione nell’intervallo 0.075 – 0.1 °C. In altre parole, la temperatura di ebollizione passa da 100 °C all’intervallo di temperature compreso tra 100.08 e 100.1 °C.
Ancora pensate, voi adulti, che chiedere se aggiungere il sale prima o dopo l’ebollizione sia una domanda seria?
Edit: nel calcolo dell’innalzamento ebullioscopico non ho tenuto conto del coefficiente di Vant’Hoff che, per il cloruro di sodio, è pari a 2. Questo vuol dire che, introducendo questo fattore di correzione, l’aumento di temperatura dell’acqua a cui si aggiungono grosso modo una decina di grammi di NaCl è intorno a 0.1-0.2 °C. Insomma, da 100 °C si passa a 100.1-100.2 °C. Rimane sempre valida la domanda: ancora pensate, voi adulti, che chiedere se aggiungere il sale prima o dopo l’ebollizione sia una domanda seria?
Fonte dell’immagine di copertina



Vorrei sapere perché si usa il di cloruro di calcio x impedire la formazione del ghiaccio sulle strade e se ha effetti nocivi nell’ambiente. Grazie
Vorrei sapere se è possibile calcolare l’abbassamento crioscipico quando si aggiunge il sale x evitare il formarsi del ghiaccio. Grazie Antonella
Davvero interessante. Mi può dire perché quando si aggiunge il sale si formano tantissime bolle? Grazie. Antonella