L’acqua e la forza dei legami a idrogeno
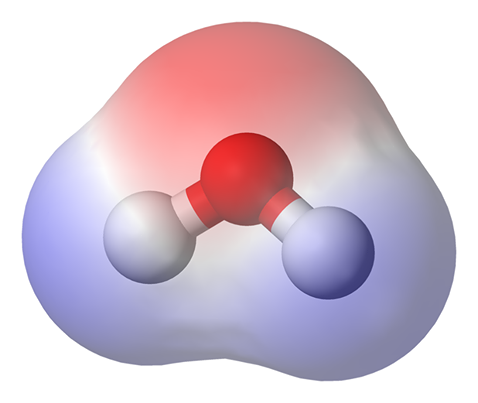
Il ruolo che i legami a idrogeno svolgono nel comportamento dell’acqua è già stato evidenziato più volte in altre Pillole di scienza [1-3]. La formazione dei legami a idrogeno è stata ascritta al momento dipolare dell’acqua, ovvero al fatto che una parziale carica positiva è presente sugli atomi di idrogeno mentre una parziale carica negativa è presente sull’atomo di ossigeno. Grazie a questa separazione di carica, ogni molecola di acqua è in grado di circondarsi di un massimo di altre 4 molecole di acqua che sono agganciate alla prima attraverso 4 legami a idrogeno. Di questi, due legami sono ottenuti grazie al contributo degli elettroni delle coppie solitarie, gli altri due grazie al contributo degli atomi di idrogeno.
All’aumentare del numero di molecole di acqua che circondano una data molecola H2O, si osserva un comportamento singolare. Infatti, man mano che il numero di molecole di acqua aumenta intorno ad una di riferimento, si osserva un “rafforzamento” dei legami a idrogeno che la molecola di riferimento forma con quelle vicine. Questo “rafforzamento” è dovuto ad un incremento del modulo, ovvero del valore, del momento dipolare che passa da 1.85 D (la D è l’unità di misura del momento dipolare e si legge Debye) per l’acqua monomerica (cioè l’acqua da sola) a circa 3 D per l’acqua inserita in un cluster (cioè un grappolo, un insieme) fatto da 32 molecole di acqua.
Come si spiega il cambiamento del momento dipolare e, di conseguenza, il rafforzamento dei legami a idrogeno?
Sembra che il ruolo più importante nel definire il momento dipolare di una molecola di acqua non sia ricoperto dai legami O-H, ma dalle coppie solitarie (indichiamole semplicemente con lp) presenti sull’ossigeno. Quando il numero di molecole che circondano quella di riferimento aumenta, l’angolo lp-O-lp diminuisce passando da circa 125 gradi dell’acqua singola a circa 114 gradi dell’acqua circondata da altre 32 molecole di acqua. Questa diminuzione dell’angolo descritto porta all’incremento del valore del momento dipolare e della forza coi cui la molecola di acqua riesce a legare a sé le altre molecole di acqua via legami a idrogeno. Informazioni dettagliate per i più curiosi nel riferimento [4].
Riferimenti:
[2] https://www.facebook.com/RinoConte1967/posts/1847184085503119:0
[4] Kemp & Gordon, An interpretation of the enhancement of the water dipole moment due to the presence of other water molecules. J. Phys. Chem. A, 2008, 112: 4885-4894